Bilangan Kuantum magnetik spin
Selain bilangan kuantum n, l dan ml masih terdapat bilangan kuantum yang lain yaitu bilangan kuantum magnetik spin, yang diberi simbol ms. Bilangan kuantum magnetik spin berhubungan erat dengan momentum sudut intrinsik elektron.
Momentum sudut intrinsik adalah momentum sudut yang terdapat di dalam elektron itu sendiri. Momentum sudut intrinsik sering disebut spin (rotasi) elektron. Momentum sudut intrinsik elektron ini tergantung pada momentum sudut orbital elektron.
Bilangan kuantum spin mula-mula diperkenalkan oleh Wolfgang Pauli. Waktu itu pauli mengamati spektrum atom hidrogen dengan alat yang ketelitiannya sangat tinggi.
Ia menemukan keanehan bahwa setiap garis pada spektrum atom hidrogen ternyata merupakan dua garis yang sangat berdekatan. Misalnya, garis deret Balmer yang berasal dari transisi n = 3 ke n= 2 (panjang gelombangnya 656,3 nm), sebenarnya merupakan dua garis yang berdekatan sekali (terpisah hanya pada jarak 0,14 nm).
Menurut Pauli kedua garis ini pastilah berasal dari transisi dua tingkat energi yang sangat berdekatan. Pauli menduga bahwa kedua tingkat energi berhubungan dengan momentum sudut intrinsik elektron yang berbeda dengan momentum sudut orbital.
 |
| Gambar 1: elektron diandaikan sebagai bola pejal yang berotasi terhadap porosnya |
 |
| Gambar 2: momentum sudut intrinsik |
Gerakan elektron mengelilingi inti atom akan menghasilkan medan magnetik. Medan magnetik ini akan berinteraksi dengan medan magnetik akibat momentum sudut intrinsik elektron. Hasil interaksi ini menyebabkan efek Zeeman internal, di mana garis-garis spektral akan terpecah menjadi dua. Pauli menyebutkan bilangan kuantum yang berhubungan dengan momentum sudut intrinsik elektron ini dengan nama bilangan kuantum magnetik spin yang memiliki nilai: ms = ½ dan ms = – ½.
Untuk menjelaskan lebih lanjut ide dari Pauli, Goudsmith dan Uhlenbeck memisalkan elektron seperti bola pejal bermuatan, gambar 1. Momentum sudut intrinsik elektron dianggapnya sebagai akibat rotasi elektron terhadap sumbunya (seperti rotasi bumi). Pada waktu elektron berotasi berlawanan dengan gerak jarum jam, elektron mempunyai bilangan kuantum magnetik ms = +1/2 dan ketika berotasi searah jarum jam ms = -1/2.
Besarnya momentum sudut intrinsik atau spin (rotasi) elektron ini diberikan oleh rumus
Dengan s = ½ (s dinamakan bilangan kuantum spin). Proyeksi spin elektron ini pada sumbu z diberikan oleh
Dengan ms menyatakan bilangan kuantum magnetik spin. Menurut Goudsmith dan Uhlenbeck, momen magnetik akibat spin elektron diberikan oleh rumus:
Medan magnet akibat spin elektron ini akan berinteraksi dengan medan magnetik akibat gerakan orbit elektron. Jika medan magnetik akibat gerakan orbit adalah B (berarah ke sumbu z) maka energi akibat interaksi ini adalah (analog dengan penurunan efek Zeeman):
Karena ms mempunyai dua harga yaitu ms = ±1/2, maka tingkat energi elektron pecah menjadi dua:
Sebenarnya anggapan elektron seperti bola pejal yang berotasi tidak dapat dibenarkan. Model ini akan memberikan kecepatan rotasi elektron menjadi beberapa kali kecepatan cahaya.
Anggapa modern mengatakan bahwa spin elektron disebabkan aliran energi yang timbul akibat gelombang elektron (ingat konsep partikel-gelombang de Broglie). Walaupun demikian, gambaran elektron sebagai bola pejal yang berotasi masih sering dipakai untuk menyederhanakan persoalan.
Selain elektron, contoh partikel lain yang mempunyai spin adalah proton dan neutron. Besar spin proton dan neutron sama dengan spin elektron, yaitu:
(bilangan kuantum spin proton dan neutron = 1/2). Foton (bilangan kuantum spin foton, s = 1) mempunyai spin √2ℏ.

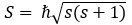
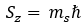




Posting Komentar untuk "Bilangan Kuantum magnetik spin"